Platone ed il tetraedro del fuoco
Negli scorsi contributi abbiamo introdotto l’elemento “fuoco”, intrinsecamente connesso con il tema della sicurezza sul lavoro, sulla prevenzione degli incendi ed altri temi.
Fra i tanti pensatori del passato che hanno espresso nel loro sistema filosofico una particolare speculazione sugli elementi naturali, anche Platone nel Timeo (Τίμαιος), (forse l’ultimo dialogo da lui approntato) dà ampi spazi di riflessione in tal senso.
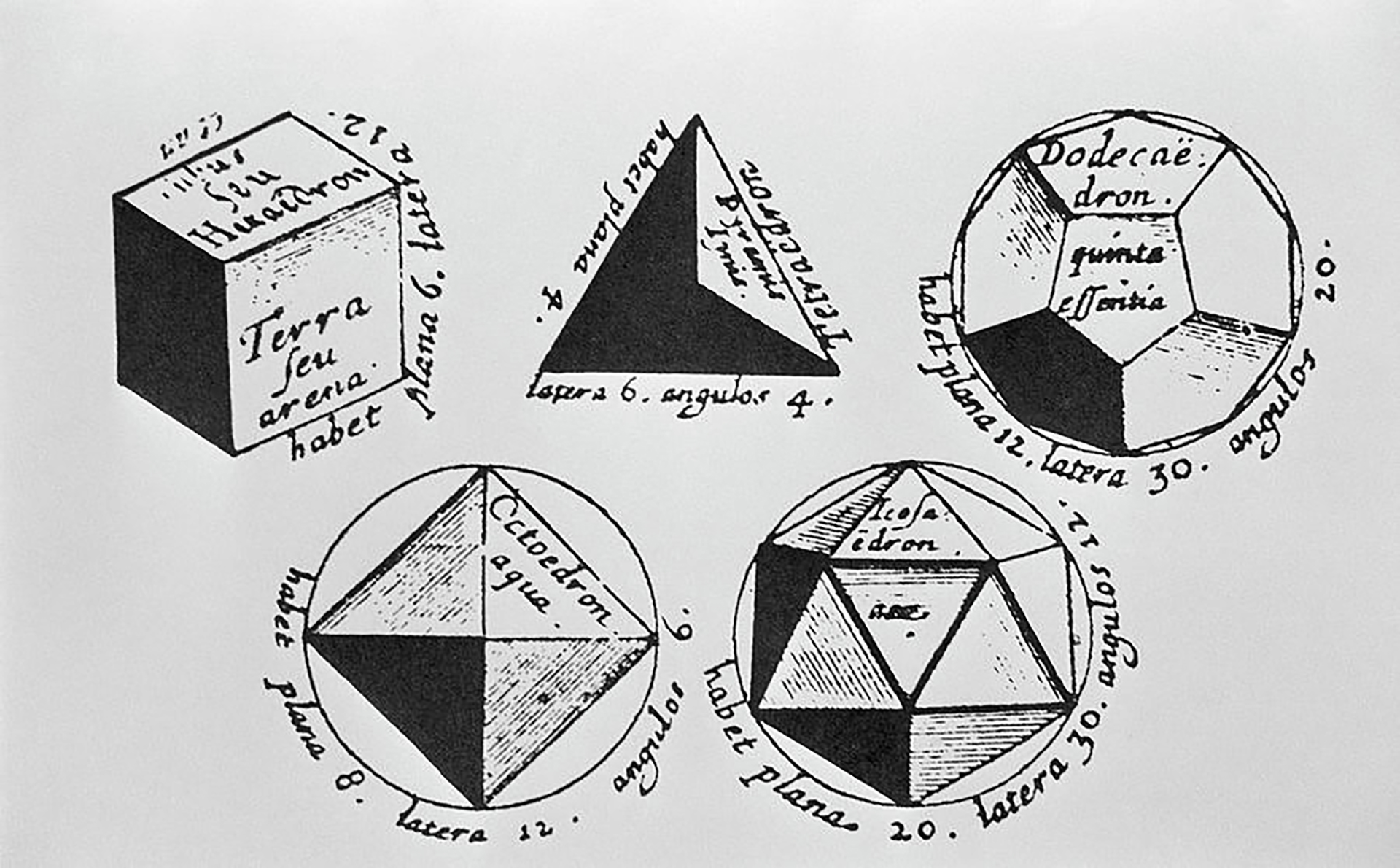
Si spinge anche oltre, “geometrizzandoli” in un insieme di figure solide, ribattezzate per l’appunto in suo onore solidi platonici. Diamo lettura di queste bellissime pagine riportandone un breve stralcio.
“Ma lasciamo perdere questa questione, e le specie che ora si sono formate mediante il ragionamento distribuiamole nel fuoco, nella terra, nell’acqua e nell’aria. E alla terra assegniamo la figura cubica (cubo o esaedro): fra le quattro specie, infatti, la terra è quella meno soggetta a movimento, e fra tutti i corpi è la più plasmabile, ed è assolutamente necessario che sia tale quel corpo che ha le basi più salde: fra i triangoli che abbiamo posto in principio, è per natura più salda la base di triangoli a lati uguali che quella di quelli a lati disuguali, e la figura piana, che è formata dall’una e dall’altra specie di triangoli, il tetragono equilatero, sia nelle parti, sia nel tutto, è inevitabilmente più stabile del triangolo equilatero.
Perciò assegnando questa forma alla terra, manteniamo un discorso verosimile, mentre all’acqua assegniamo la forma meno soggetta a movimento fra le altre, al fuoco la più mobile, all’aria quella intermedia: e attribuiamo il corpo più piccolo al fuoco, il più grande all’acqua, quello intermedio all’aria. E ancora il più acuto al fuoco, il secondo per acutezza all’aria, il terzo all’acqua. Fra tutte queste forme, allora, quella che ha il minor numero di basi è inevitabile sia la più soggetta a movimento, essendo fra tutte le altre la più tagliente e la più acuta in ogni sua parte, ed inoltre la più leggera, essendo formata dal minor numero delle medesime parti: e la seconda di queste forme ha tutte queste proprietà in secondo grado, e la terza le possiede in terzo grado.
Secondo un ragionamento corretto e verosimile, la figura solida della piramide sia l’elemento e la semenza del fuoco (tetraedro), seconda per generazione diciamo che sia la figura dell’aria (ottaedro), terza quella dell’acqua (icosaedro). Tutte queste figure bisogna concepirle così piccole, che nessuna delle singole parti di ciascuna specie è visibile ai nostri occhi per la sua piccolezza, ma, se molte si riuniscono insieme, è possibile vedere le loro masse: per quanto riguarda le proporzioni relative ai numeri, ai movimenti e a tutte le altre proprietà, il dio, dopo aver realizzato in ogni parte alla perfezione queste cose, finché la natura della necessità si lasciava spontaneamente persuadere, le unì in proporzione ed armonia.”
Anche in questo caso, possiamo stabilire un costruttivo fil rouge fra filosofia e scienza, ovvero associando in maniera romantica il principio teorico del tetraedro platonico – che rappresenta il fuoco stesso – al tetraedro del fuoco, un principio pratico che schematizza la formazione della combustione e dunque di un incendio.
In questo brano il filosofo greco sembra proprio voler significare la dinamicità e la complessità del fenomeno fuoco, così intimamente legato all’aria ed all’acqua: due elementi rispettivamente “agevolatore” e “smorzatore” del fuoco stesso.
Che cos’è una combustione?
Andando con ordine, e consultando pregevole letteratura definiamo la combustione come quel processo in cui qualunque reazione chimica nella quale è presente un combustibile, sostanza ossidabile, che reagisce con un comburente, sostanza ossidante, liberando energia, generalmente sotto forma di calore.
Questo avviene perché i combustibili perdono elettroni entrando in contatto con i comburenti, cioè si ossidano, mentre i comburenti stessi si riducono, cioè acquistano elettroni.
Questo “scambio” di elettroni genera come detto calore, il quale innalza la temperatura dei partecipanti alla reazione e molto spesso la porta a valori tali per cui essi irradiano energia elettromagnetica, con lunghezze d’onda comprese nel campo del visibile (visibilità della fiamma).
Le zone di reazione ci appaiono pertanto luminose, ed è possibile parlare di fiamme. Le sostanze combustibili più comuni sono, in larga parte, composte da idrogeno (H) e carbonio (C), mentre quelle comburenti incorporano in larghissima parte ossigeno (O).
Nelle combustioni in aria si ha quindi formazione di acqua liquida (H2O) o vaporizzata e di anidride carbonica (CO2), producendo quelle che si definiscono combustioni complete.
Di converso troviamo anche le combustioni incomplete, dovute alla non sufficiente quantità di ossigeno, dove ritroviamo inoltre la formazione di monossido di carbonio (CO).
Attenzione, quest’ultima definizione non deve trarci in inganno; non significa che il combustibile non sia bruciato interamente, ma solo che il carbonio non si è trasformato del tutto in anidride carbonica: il combustibile stesso perciò potrebbe essersi consumato completamente.
Con la combustione incompleta si ha lo svantaggio, come accennato,di generare anche il monossido di carbonio, che come visto in altre occasioni è un composto tossico. Un ulteriore punto debole è la produzione di una quantità d’energia inferiore rispetto alla combustione completa, a parità di peso del combustibile.
Questo è fondamentale quando si avviano processi di combustione deliberati, utilizzati magari per l’appunto ai fini di produzione del calore (riscaldarsi, cucinare ecc …).
Affermiamo dunque che la combustione è una reazione esotermica che libera calore perché i reagenti possiedono più energia dei prodotti di reazione.
In aggiunta poi, mescolati ai prodotti di reazione di carbonio e idrogeno troviamo di solito i prodotti di reazione dello zolfo presente in quasi tutti i combustibili, ed anche gas inerti come l’azoto (N), gas derivanti dalla decomposizione termica di eventuali sostanze organiche, ed infine incombusti e residui minerali. Tutti questi prodotti insieme vengono chiamati nel complesso fumi.
Da questa compiuta definizione appena elaborata, è chiaro che le 4 “superfici” in gioco del tetraedro d’incendio sono:
- Combustibile, definito anche come carburante, se utilizzato per alimentare motori a combustione interna ad accensione comandata ( o a scoppio) od ad accensione spontanea (diesel) o ancora turbine a gas. Esempi pratici di conoscenza comune sono benzina, gasolio, cherosene, GPL, metano;
- Comburente, fra cui ritroviamo sostanze inorganiche quali clorati, perclorati, bromati, permanganati, persolfati, nitrati e nitriti, ipocloriti, così come anche i perossidi organici ed inorganici;
- Fonte d’innesco, che apporta l’energia sufficiente per dar inizio alla reazione di ossidoriduzione ;
- Reazione a catena, ovvero la precisa sequenza degli accadimenti per far sì che la combustione si sviluppi, con le giuste proporzioni dei fattori in gioco appena menzionati. Più in dettaglio, essa comporta la formazione di radicali (cioè entità molecolari molto reattive e con una vita media molto breve), i quali a loro volta ne generano altri ed altri ancora.
È molto importante perciò, ai fini attuativi di un’efficiente ed efficace lotta antincendio per la tutela della sicurezza e della salute dei lavoratori ed in generale dei cittadini, conoscere e capire i processi inerenti al fuoco, ed anche alcune piccole nozioni di chimica.

Un po’ di chimica del fuoco
È interessante pertanto analizzare le reazioni chimiche appena citate sotto il punto di vista delle formule brute, esplorando i vari tipi di prodotti e reagenti che possono venir fuori dallo sviluppo di una combustione, che può dar luogo ad un incendio.
Si precisa che comunque “combustione” ed “incendio” sono due termini che non posso essere utilizzati come sinonimi.
Infatti, l’incendio è certamente una reazione di combustione, ma più appropriatamente è un evento distruttivo causato dall’azione del fuoco,non controllato, con effetti dannosi sulle cose e sulle persone e che avviene in luoghi non preparati allo scopo.
Dunque, non parliamo certamente di incendio nel caso ad esempio della combustione che avviene dentro i motori dei mezzi di locomozione.
Definiamo più avanti alcune basilari reazioni di combustione.
Combustione dell’idrogeno
l’idrogeno esiste allo stato gassoso sotto forma di molecola H2 ed usa la molecola O2 per dare la seguente reazione:
H2 + ½ O2 → H2O + 0,240 MJ
In pratica, questa equazione afferma che 2 g di idrogeno, in reazione con 16 g d’ossigeno, formano 18 g d’acqua liberando al contempo 0,240 MJ (megajuole, ovvero 57,3 kcal) sotto forma di calore.
Combustione del carbonio
Il carbonio si combina con l’ossigeno seguendo due possibili strade. La prima è
C + ½ O2 → CO + 0,135 MJ
Parliamo cioè della combustione incompleta.
La seconda forma è invece la seguente:
C + O2 → CO2 + 0,407 MJ
Ovvero la combustione completa. È chiaramente comprensibile quanto la seconda reazione sia maggiormente performante dal punto di vista calorifico.
Le reazioni appena viste sono abbastanza importanti, quanto meno perché da esse possiamo ricavare il cosiddetto potere calorifico, un fattore essenziale nella classificazione e nell’utilizzo degli idrocarburi, ed in generale dei combustibili, anche dal punto di vista della movimentazione e del trasporto merci.
Combustione del metano
Per significare maggiormente quanto detto sopra, prendiamo in esempio e mostriamo la combustione del metano (CH4), ovviamente con alcune semplificazioni. Si presuppone che questo importante gas sia in miscela con l’aria, e che essa abbia un rapporto 1:4 con le sue componenti principali ossigeno ed azoto, cioè O2 + 4N2.
Pertanto, abbiamo che:
CH4 + 2 O2 + 8 N2 → CO2 + 2 H2O + 8 N2 + 0,805 MJ
Delineiamo alcune considerazioni. Da una breve lettura dell’equazione presentata, notiamo che l’azoto non interviene nei processi di combustione. È un gas che abbiamo definito perciò inerte, ed è sfruttato industrialmente anche per questa peculiare qualità.
In verità, nelle combustioni ad alta temperatura, una quota parte di azoto dell’aria si combina con l’ossigeno attraverso un complesso processo chimico-fisico non riferibile alla combustione del combustibile.
Sono creati dunque in questa occasione i composti chimici degli ossidi di azoto (NOx), che abbiamo diffusamente analizzato in altri contributi, altamente nocivi per l’uomo e l’ambiente.
La velocità di combustione
Un altro importante parametro per lo sviluppo dei processi di combustione è la velocità di reazione, che definisce in pratica la velocità alla quale i reagenti in una reazione si trasformano nei prodotti.
Ciò è strettamente correlato principalmente alla maggiore o minore difficoltà con cui le molecole, durante le loro collisioni, riescono a superare l‘energia di attivazione necessaria per far passare le molecole di sistema iniziale di reagenti ad uno stato finale in cui si ottengono i prodotti di reazione.
Il parametro che più influenza la velocità di reazione è sicuramente la temperatura, che in maniera direttamente proporzionale più aumenta più le molecole sono “veloci”, collidendo con maggiore frequenza ed efficacia.
Al di sopra della cosiddetta temperatura di ignizione le molecole hanno sufficiente energia cinetica per superare la barriera di attivazione e quindi dar luogo ai complessi attivati e la combustione è rapida ed evidente.
Offriamo al lettore alcuni spunti di riflessione, soprattutto per dettagliare maggiormente cosa significhi complesso attivato. Esso definisce una determinata configurazione assunta dalle molecole delle sostanze reagenti in corrispondenza di uno stato di transizione.
In altre parole, siamo in corrispondenza del “picco” nel grafico dell’entalpia (dal greco ἐνϑάλπω “riscaldare”) del sistema termodinamico.
Fonte: Wikipedia, voce “Stato di attivazione”
Ci troviamo quindi in una fase intermedia altamente instabile, in cui i reagenti si stanno per trasformare in prodotti di reazione, a causa della “rottura” dei legami dei reagenti stessi per formarne di nuovi e diversi.
La velocità di reazione menzionata dipende inoltre dalla concentrazione, cioè dal numero per unità di volume, dei complessi attivati che si formano. In definitiva, sotto una certa temperatura, detta appunto temperatura di accensione o temperatura di ignizione, le collisioni molecolari sono poco probabili e la combustione procede perciò in forma lenta o latente.
Sopra la temperatura di accensione, invece, un gran numero di collisioni danno luogo a complessi attivati e perciò la concentrazione dei complessi attivati cresce e la combustione diventa più rapida.
In generale, il pericolo di infiammabilità è associato anche ad altri elementi criteri di valutazione, fra cui ritroviamo il summenzionato potere calorifico, ma anche il punto di infiammabilità, la temperatura di accensione o autoaccensione i limiti di infiammabilità ed il campo di infiammabilità, assieme ai limiti di esplosività ed il campo di esplosività.
Daremo maggiori riferimenti in tal senso in successivi contributi, in cui forniremo anche strumenti su come comunicare il pericolo e la percezione comune nei suoi confronti.
Bibliografia ed approfondimenti
- Audrito, Giorgio & Battisti, Ubertino & Borsero, Massimo & Raffero, Alberto & Tassoni, Saverio & Testa, Luisa. (2016). Esplorazione dei solidi e oltre: fare geometria con gli Zometool. A cura di Ornella Robutti.. 10.13140/RG.2.1.4732.6483.
- Platone, Timeo, in: “Dialoghi politici lettere”, a cura di Francesco Adorno, UTET 1996.
- A.A.V.V., voce Timeo, in Dizionario di filosofia, Istituto dell’Enciclopedia Italiana, 2009.
- Walter Isaacson, Leonardo da Vinci, Mondadori Libri S.p.a.. 2017.
- A.A.V.V., voce Paciòli, Luca, in Enciclopedia on line, Istituto dell’Enciclopedia Italiana.
- Corso di formazione sulla prevenzione incendi, in vigilfuoco.it, a cura del Corpo Nazionale dei Vigili del Fuoco – Comando Vigili del Fuoco Milano, url: https://www.vigilfuoco.it/sitivvf/milano/viewpage.aspx?s=281&p=2601 .
- A.A. V.V., voce Carburanti, in Dizionario di Economia e Finanza, Istituto dell’Enciclopedia Italiana, 2012.
- A.A. V.V., voce Incendio, in Thesaurus, Istituto dell’Enciclopedia Italiana, 2018.
- Nebbia G. Lezioni di Merceologia, Gius. Laterza & Figli Spa, Roma-Bari, 1995.
- Turns, Stephen (2011). An Introduction to Combustion: Concepts and Applications.
- Antonio Di Meo, voce Energia di attivazione, in Enciclopedia della Scienza e della Tecnica, Istituto dell’Enciclopedia Italiana, 2008.
- Antonio Di Meo, voce Complesso attivato in Enciclopedia della Scienza e della Tecnica, Istituto dell’Enciclopedia Italiana, 2008.
- IUPAC. Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.